D. CARDANI
Khoa Khoa học Y sinh cho Sức khỏe “Città Studi”, Đại học Milan, Milan, Ý
Đăng trên tạp chí Minerva Gastroenterologica e Dietologica (2014 Mar; 60 (1): 71-8). Tạp chí chuyên về dinh dưỡng, tiêu hóa và ăn kiêng, Italy
Mục tiêu: Trong nghiên cứu này, chúng tôi đã đánh giá khả năng thực phẩm bổ sung COLOSTRONONI được sử dụng như một tác nhân phòng ngừa và điều trị trong các bệnh khác nhau được đặc trưng bởi sự thay đổi cân bằng nội môi đường ruột với những thay đổi trong thành phần của hệ vi sinh vật, thay đổi hình thái và chức năng, và cũng như viêm biểu mô.
Phương pháp: Hoạt động tế bào của COLOSTRONONI đã được thử nghiệm trong mô hình in vitro của biểu mô ruột dựa trên dòng tế bào Caco-2. Chúng tôi đã thử nghiệm khả năng của COLOSTRONONI trong việc kích thích sự thay đổi tế bào, đánh giá tốc độ phát triển của tế bào với xét nghiệm tăng sinh WST-1. Chúng tôi cũng đã kiểm tra khả năng của COLOSTRONONI trong việc tăng cường biểu hiện gen của Interleukin-8 (IL-8) bằng xét nghiệm Real Time PCR. IL-8 là một yếu tố hóa học cơ bản liên quan đến các hiện tượng viêm và kiểm soát cân bằng nội môi của mô.
Kết quả: COLOSTRONONI có thể kích thích sự thay đổi tế bào trong mô hình in vitro được đề xuất và cho thấy hoạt động tích cực trong việc tăng biểu hiện gen của IL-8. Cả hai khía cạnh được quan sát là cơ bản để thiết lập các cơ chế sửa chữa tổn thương mô.
Kết luận: Các kết quả thu được chỉ ra rằng COLOSTRONONI có thể được ứng dụng lâm sàng trong điều trị các rối loạn tiêu hóa đặc trưng bởi sự suy giảm tính thấm của ruột, trong các bệnh viêm ruột, các bệnh rối loạn tiêu hóa, viêm dạ dày và các dạng thay đổi bệnh lý của niêm mạc như bệnh celiac và nhạy cảm với gluten.
Từ khóa: Đường tiêu hóa – Niêm mạc dạ dày – Tiêu viêm – Sữa non – Morinda.
Corresponding author: D. Cardani, via E. De Amicis 3, 20814 Varedo, Monza-Brianza, Italy.
E-mail: diegocardan@tiscali.it
Đường tiêu hóa là một trong những cơ quan chuyên biệt nhất của cơ thể con người và đây là khu vực cơ thể tiếp xúc với thế giới bên ngoài lớn nhất (khoảng 400 m²). Trong suốt quá trình phát triển của mình, nó đã chuyên biệt thực hiện hai chức năng tương phản cơ bản và thiết thực: bộ lọc chuyên biệt có thể đảm bảo sự hấp thụ tối ưu các chất dinh dưỡng và hàng rào chọn lọc chống lại các mầm bệnh của bất kỳ bản chất nào.
Niêm mạc, hệ vi sinh đường ruột, các điểm nối giữa các tế bào và hệ thống miễn dịch của ruột (mô bạch huyết liên kết ruột, GALT) là bốn cấp độ cơ bản của hàng rào ruột. [4, 5] Đường tiêu hóa cũng là một hệ thống miễn dịch tâm lý-thần kinh-nội tiết (PNEI) [6] có khả năng tiết ra các neuropeptide, neurohormone, hormone và cytokine góp phần quyết định vào việc kiểm soát cân bằng nội môi sinh lý tại chỗ và hệ thống, và có thể phản ứng với nhiều loại kích thích khác nhau: ví dụ như tế bào gốc có các thụ thể cho hormone giải phóng cortico-trophin (CRH) và phản ứng với stress làm tăng tính thấm của biểu mô ruột [7] và các tế bào ruột có khả năng tiết tryptophan.[8] Có thể khẳng định rằng đường tiêu hóa là một mô hình vi mô nội tiết miễn dịch thần kinh với vai trò quan trọng của riêng nó trong việc kiểm soát cân bằng nội môi, một cơ quan trung tâm để kiểm soát nội môi. Hoạt động trên đường tiêu hóa, bảo tồn hoặc thiết lập lại tính toàn vẹn mô học, chức năng PNEI và khả năng hoạt động như bộ điều khiển nội môi có nghĩa là ngăn ngừa hoặc điều trị những thay đổi bệnh lý tại chỗ và toàn thân. Duy trì cân bằng nội môi của hàng rào, đặc biệt là mối quan hệ giữa hệ vi sinh vật và hệ thống PNEI, là chìa khóa cho bộ máy dạ dày hoạt động chính xác bằng cách duy trì trạng thái viêm “sinh lý” hoặc “được kiểm soát” là tình trạng hoạt động bình thường của niêm mạc tiêu hóa, điều cần thiết để đảm bảo khả năng dung nạp miễn dịch.[9] Sự phá vỡ cân bằng giữa kiểm soát thần kinh-miễn dịch-nội tiết tố đối với chức năng niêm mạc và thành phần của hệ vi sinh là nguyên nhân của sự thay đổi giữa viêm sinh lý và bệnh lý và có thể gây ra bệnh lý đường tiêu hóa.
Một vai trò cơ bản trong việc theo dõi cân bằng nội môi (đặc biệt là viêm), và do đó đối với sinh lý ruột, được thực hiện bởi trục não-ruột (trục não-ruột, GBA): [9] tình trạng căng thẳng tinh thần có thể gây ra viêm niêm mạc ruột.
Hệ vi sinh vật đóng vai trò chính trong ý nghĩa này: sự thay đổi thành phần sinh lý của nó, gây ra bởi căng thẳng tâm thần “di chuyển” dọc theo trục GBA, làm cho nó mất vai trò kiểm soát cân bằng nội môi gây viêm với sự gia tăng các chỉ số phlogosis. Điều thú vị là hệ vi khuẩn đường ruột được tích hợp trong trục não-ruột theo hai hướng, hay nói đúng hơn, không chỉ hệ vi sinh vật bị ảnh hưởng bởi tình trạng căng thẳng tâm lý mà nó có thể ảnh hưởng đến hệ thần kinh trung ương và hành vi; ví dụ, nó có thể tạo ra các chất chuyển hóa trong biểu mô có khả năng ảnh hưởng trực tiếp đến hệ thần kinh trung ương (ví dụ, làm thay đổi sự chuyển hóa của tryptophan với biểu hiện hậu quả là hội chứng trầm cảm) [9] và thúc đẩy sự hoạt hóa của miễn dịch niêm mạc phản ứng (sự biểu hiện của các thụ thể Toll như -2, -4 và 5 được điều chỉnh bởi sự dao động trong thành phần của hệ vi sinh) .[9]
Sự thay đổi của trục não-ruột gây ra các bệnh lý có thành phần tâm lý rõ rệt như hội chứng ruột kích thích (một bệnh lý có tỷ lệ mắc bệnh cao ở các nước công nghiệp phát triển trung bình 15% dân số) .[10, 11] Các thay đổi trong chức năng của GBA cũng có trong các bệnh lý như bệnh Crohn (cứ 100.000 người thì có 27 đến 48 người) và trong các bệnh lý viêm cấp tính và mãn tính khác (với tỷ lệ cao ở các nước phương Tây) và cũng là một trong những bệnh quan trọng nhất dấu hiệu của một chế độ ăn uống không lành mạnh (lạm dụng rượu và / hoặc “đồ ăn vặt”).
Những tình trạng bệnh lý này có sự mất cân bằng nội môi của ruột trong số các nguyên nhân đồng thời của chúng dẫn đến sự thay đổi đáng kể của hàng rào ruột và đặc biệt là làm mở các nút thắt chặt (TJ) của các tế bào biểu mô đỉnh. [12-14]
Sự thay đổi của các hệ thống nối, khi đối mặt với biểu hiện viêm làm tổn thương lớp niêm mạc, [12, 15-18] làm thay đổi hình thái điển hình của biểu mô ruột về hình dạng và cấu trúc (kích thước và sự phân bố của nhung mao) và thành phần tế bào của mô (thay đổi mối quan hệ số lượng giữa các loại tế bào thường có); hơn nữa, việc kích hoạt đáp ứng miễn dịch đảm bảo rằng các tế bào của hệ thống miễn dịch dưới dạng thâm nhiễm viêm [19, 20] cũng được tìm thấy trong biểu mô ruột.
Trong số các yếu tố sinh lý liên quan đến việc điều chỉnh các hệ thống nối, chế độ ăn uống chắc chắn là quan trọng nhất vì nó đại diện cho ảnh hưởng cơ bản đối với các tình trạng viêm mãn tính; nó đã được chứng minh làm cách nào một số chất dinh dưỡng có thể điều chỉnh cả tích cực (chất chống oxy hóa như vitamin C và E) và tiêu cực (chẳng hạn như axit béo với số lượng quá cao) chức năng của hàng rào ruột điều chỉnh TJs, sản xuất chất nhầy, và sự luân chuyển tế bào biểu mô.[21, 22] Chế độ ăn uống điển hình của các nước phát triển, cái gọi là “Chế độ ăn uống phương Tây”, không cân bằng và quá nhiều chất béo, muối, đường và thực phẩm biến đổi gen (GMO), được coi là ảnh hưởng chính đến sự phát triển của các bệnh lý điển hình của thế giới công nghiệp hóa phương Tây. Ví dụ, bệnh tiểu đường, béo phì và các khối u đại trực tràng là những bệnh lý được đặc trưng bởi tình trạng viêm cận lâm sàng tiềm ẩn và dai dẳng, như đã mô tả trước đây, chắc chắn cũng ảnh hưởng đến tính toàn vẹn của biểu mô ruột và thành phần của hệ vi khuẩn sống chung.[23, 24]
Các phương pháp điều trị khác nhau có sẵn để thay đổi bệnh lý của hàng rào ruột và cách thích hợp nhất nên được chọn là theo thành phần hàng rào đã bị thay đổi. Một trong những lựa chọn quan trọng nhất là phục hồi hệ vi sinh vật thông qua việc lựa chọn các chủng vi khuẩn có lợi, kết hợp chế độ ăn uống một cách thích hợp (liên quan đến lượng calo và thành phần), hạn chế liệu pháp kháng sinh không cần thiết nếu có thể, các điều kiện dẫn đến sự thay đổi của hệ vi sinh vật (tiểu đường, rối loạn nội tiết, rối loạn nhu động ruột, v.v.). Việc sử dụng thực phẩm bổ sung dựa trên sữa non bò đông khô và Morinda citrifolia (Noni) như COLOSTRONONI (Guna SpA, Milan, Ý), có thể thiết lập lại cân bằng nội môi đường ruột với tác động trực tiếp trên hệ vi sinh và tính toàn vẹn của biểu mô ruột, có được chứng minh hiệu quả trong việc ngăn ngừa và điều trị các đợt làm thay đổi chức năng tiêu hóa trực tiếp (viêm dạ dày ruột với sự thay đổi cấu trúc và tính toàn vẹn của niêm mạc, bệnh lý viêm ruột, tiêu chảy và các dạng bệnh lỵ) và gián tiếp (cúm và các tình trạng tương tự như cúm), rối loạn tiêu hóa do điều trị kháng sinh và cả những tình trạng căng thẳng về tâm sinh lý là thứ phát từ chức năng ruột bị thay đổi. Việc tích hợp COLOSTRONONI trong chế độ ăn uống cũng có thể có tác dụng phòng ngừa tốt các tác hại nói trên của chế độ ăn uống không cân bằng.
Vật liệu và phương pháp
COLOSTRONONI là thực phẩm bổ sung dựa trên sự kết hợp của sữa bò non bào chế bằng kỹ thuật đông khô và Morinda citrifolia (nước ép trái cây Nhàu dạng bột) tạo công thức hòa tan trong miệng có tác dụng nhanh nhờ hoạt động hiệp đồng của các thành phần và đặc trưng cho chính nó hoạt động rõ rệt để duy trì hoặc phục hồi cân bằng nội môi ruột, đặc biệt liên quan đến khả năng thiết lập lại thành phần chính xác của hệ vi khuẩn và sự luân chuyển sinh lý của tế bào biểu mô ruột. Việc sử dụng COLOSTRONONI trong một mô hình in vitro của biểu mô ruột cho thấy các đặc tính của nó trong điều hòa sinh lý của sự luân chuyển tế bào và của sự điều hòa hóa học, các cơ chế liên quan đến việc bảo vệ và tái lập mô bị tổn thương. Để so sánh thêm, để đánh giá vai trò hiệp đồng của nước ép NONI, một nhóm trong đó các tế bào được xử lý chỉ bằng sữa non của bò cũng được thêm vào các thử nghiệm.
Dòng tế bào và thuốc thử
Dòng tế bào Caco-2 (tế bào biểu mô của ung thư biểu mô ruột kết ở người) được lấy từ ATCC-American Type Culture Collection (Manassas, VA, USA). Các tế bào Caco-2 được nuôi cấy trong môi trường Eagle’s medium (DMEM) của Dulbecco với L-glutamine (Invitrogen / Life Technologies, Carlsbad, CA, USA), bổ sung 10% huyết thanh thai bò (FBS) (Invitrogen / Life Technologies), penicillin G muối natri (200 U/mL) và streptomycin sulphat (200 µg/mL) (Sigma-Aldrich, St Louis, MO, Hoa Kỳ), 1 mmol/L natri pyruvate, 1% axit amin không thiết yếu (tất cả sản xuất bởi SigmaAldrich). Các tế bào được ủ ở 37 ° C với 5% CO2 ở độ ẩm được kiểm soát.
Colostrum và COLOSTRONONI (Guna S.p.A.) đã được hòa tan trong cùng một môi trường để thu được dung dịch chứa 2% cả hai sản phẩm.
Yếu tố hoại tử khối u TNF-α (Sigma-Aldrich) được điều chế bằng cách pha loãng trong môi trường hoàn chỉnh để có nồng độ cuối cùng là 100 ng mL.
Thử nghiệm tăng sinh WST-1
Đường cong tăng trưởng tế bào được đánh giá bằng xét nghiệm tăng sinh tế bào WST-1 (Roche Molecular Biochemicals, Penzberg, Đức), đo lường hoạt động dehydrogenase của ty thể, một hệ thống chỉ hoạt động trong tế bào sống.
1×104 tế bào Caco-2 được mạ trong giếng của tấm 96 giếng (Corning, Tewksbury, MA, USA). Khi đã đạt đến trạng thái đơn lớp và sau khi biệt hóa thành tế bào ruột trong 21 ngày, các tế bào được mạ và xử lý nhân ba theo sơ đồ sau trong 24 giờ:
– Nhóm 1: STARVED: tế bào nuôi cấy trong môi trường DMEM không có bổ thể;
– Nhóm 2: UNTR: tế bào được nuôi cấy trong môi trường hoàn chỉnh;
– Nhóm 3: COLOSTRUM: tế bào được nuôi cấy trong môi trường hoàn chỉnh có bổ sung 2% Colostrum;
– Nhóm 4: COLOSTRUM NONI: tế bào được nuôi cấy trong môi trường hoàn chỉnh có bổ sung 2% COLOSTRONONI.
Sau 24 giờ xử lý, WST-1 được thêm vào mỗi giếng của tấm 96 giếng với độ pha loãng cuối cùng là 1:10. Nó được để ủ trong 1 giờ ở 37°C, độ hấp thụ sau đó được đọc ở 440 m, sử dụng máy đọc đĩa vi mô Dynatech MR5000 (Dynatech, Billinghurst, Sussex, Vương quốc Anh).
Đánh giá biểu hiện IL-8
2 × 105 tế bào Caco-2 được mạ trong giếng của tấm 24 giếng (Corning). Khi đạt đến trạng thái đơn lớp và sau khi biệt hóa thành tế bào ruột trong 21 ngày, các tế bào được mạ và xử lý nhân ba theo sơ đồ sau trong 24 giờ:
– Nhóm 1: UNTR: tế bào chỉ nuôi cấy trong môi trường hoàn chỉnh;
– Nhóm 2: TNF-α: tế bào được nuôi cấy trong môi trường hoàn chỉnh với 100 ng/mL TNF-α;
– Nhóm 3: TNF-α + COL: tế bào được nuôi cấy trong môi trường hoàn chỉnh có bổ sung 2% Sữa non và 100 ng/mL TNF-α;
– Nhóm 4: TNF-α + COL.NONI: tế bào được nuôi cấy trong môi trường hoàn chỉnh có bổ sung 2% COLOSTRONONI và 100 ng/mL TNF-α.
Vào cuối giai đoạn xử lý, các tế bào được ly giải và chiết tách phần RNA bằng thuốc thử TRI-Reagent và phiên mã ngược thành cDNA bằng bộ kit (Applied Biosystems, Associate City, CA, USA) theo hướng dẫn của nhà sản xuất.
Đánh giá biểu hiện gen IL-8 được đánh giá bằng Real-time PCR sử dụng bộ công cụ GoTaq® qPCR Master Mix Promega A6002 (Promega Corporation, Madison, WI, USA) và các đoạn mồi thương mại cho gen IL-8 và GADPH và 18S (Applied Biosystems).
Phản ứng PCR được thực hiện với bộ tuần hoàn nhiệt Viia 7 (Hệ thống sinh học ứng dụng). Tất cả các mẫu được đọc ở dạng gấp bốn lần.
Phân tích thống kê
Để đánh giá mức độ liên quan thống kê của các kết quả, Student’s t-test (được ghép nối đôi) đã được áp dụng. Để xây dựng và đánh giá thống kê dữ liệu, phần mềm GraphPad Prism (GraphPad Prism Software Inc., San Diego, CA, USA) đã được sử dụng. Sự khác biệt được coi là có ý nghĩa thống kê đối với các giá trị P <0,05.
Kết quả
Điều trị bằng COLOSTRONONI ảnh hưởng đến đường cong tăng sinh tế bào
Tế bào biểu mô Caco-2 được nuôi cấy trong các điều kiện thí nghiệm khác nhau trong 24 giờ và tốc độ tăng trưởng được đánh giá bằng phương pháp so màu WST-1. Các tế bào Caco-2 đại diện cho mô hình thí nghiệm cơ bản cho nghiên cứu in vitro về biểu mô ruột non, kể từ 21 ngày mạ, chúng tự động biệt hóa thành các tế bào ruột, tạo thành một lớp duy nhất và giữ cho chúng ổn định.
Các tế bào được nuôi cấy trong môi trường thiếu các chất dinh dưỡng cho thấy tốc độ tăng trưởng ngừng lại (STARVED: 100 ± 5%) và gửi lại nhóm so sánh cho các nghiệm thức khác. Các tế bào được nuôi cấy trong môi trường bình thường cho thấy sự tăng trưởng nhẹ (UNTR: 115 ± 3%). Chỉ riêng việc điều trị bằng sữa non cho thấy khả năng sinh sản tăng lên đáng kể (COLOSTRO: 130±1%; COLOSTRO vs. STARVED** P<0.01).
Các tế bào được nuôi cấy bằng COLOSTRONONI cho thấy tốc độ tăng trưởng tăng lên nhiều hơn nếu so sánh với các nhóm thí nghiệm khác (COLOSTRONONI: 225 ± 15%; COLOSTRONONI so với STARVED ** / UNTR ° ° / COLOSTRO ^^ P <0,01 )
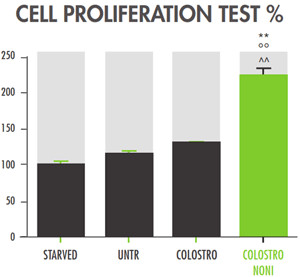
Hình 1: Mức độ tăng sinh theo tế bào
Ở cấp độ tế bào, trong mô hình in vitro, ColostroNoni cho thấy sự điều chỉnh sinh lý các tế bào ruột, bắt chước hoạt động điều hòa và phục hồi tự nhiên trong trường hợp tổn thương biểu mô tự nhiên.
Điều trị bằng COLOSTRONONI ảnh hưởng đến sự biểu hiện gen IL-8
Tế bào biểu mô Caco-2 được nuôi cấy trong các điều kiện thí nghiệm khác nhau trong 24 giờ. DNA của tế bào đã được chiết xuất và sau quá trình phiên mã ngược của nó, biểu hiện IL-8 sau đó được đánh giá bằng kỹ thuật Real Time PCR.
Điều trị bằng TNf-α (100 ng/mL) làm tăng đáng kể mức độ biểu hiện IL-8 (TNf-α: +5 lần so với UNTR). Việc điều trị bằng COLOSTRONONI (2%) ảnh hưởng đến biểu hiện IL-8 cùng với việc TNf-α tăng biểu hiện của nó (TNf-α + COL.NONI so với TNf-α + 25 lần). Việc bổ sung một mình Sữa non (2%) vào môi trường nuôi cấy với sự hiện diện của TNf-α (TNf-α + COL) không làm thay đổi đáng kể mức mRNA của IL-8 (hình 2).

Hình 2: Biểu hiện của IL-8
Colostrononi nhân lên sự tăng trưởng của IL-8 (+ khoảng 25 lần), trong khi thông thường, trong trường hợp phản ứng viêm bệnh lý, mức tăng trưởng của nó thấp hơn đáng kể so với sử dụng ColostroNoni,(+ khoảng 300-600 lần).
Thảo luận
Thuật ngữ “sữa non” mô tả loại sữa đầu tiên được sản xuất bởi tất cả các loài động vật có vú sau khi sinh con. Đây là nguồn dinh dưỡng đầu tiên và quan trọng nhất cho con vì nó chứa tất cả các axit amin thiết yếu và không thiết yếu, hormon và các yếu tố tăng trưởng, vitamin A, C, D và E, tất cả các Vitamin nhóm B, axit folic, enzim, kim loại và muối khoáng. Nó cũng thực hiện chức năng “tiêm chủng chính” vì nó giàu các globulin miễn dịch (IgA, IgG, IgM), protein (đặc biệt là lactoferrin) và các peptit kháng khuẩn, kìm khuẩn và có thể chọn lọc hệ vi sinh vật cho các chủng vi khuẩn đồng loại hữu ích hơn đối với sức khỏe của đường ruột. [25-27]
Morinda citrifolia (hay còn được gọi là Noni) là loài thực vật đã được người dân ở Nam Thái Bình Dương sử dụng trong nhiều thế kỷ và có đặc tính trị liệu đáng kể. Phần được sử dụng nhiều nhất là nước ép từ trái cây Nhàu, có đặc tính chống viêm quan trọng và kích thích hệ thống miễn dịch của sinh vật. Các chất như xeronine cũng có mặt, góp phần tăng cường và hỗ trợ toàn bộ cơ thể, đảm bảo phục hồi tâm lý-thể chất nhanh hơn và cảm giác khỏe mạnh tổng thể. [28, 29] Bảng I cho thấy các thành phần hoạt động chính của COLOSTRONONI.

Các kết quả được trình bày minh họa hoạt động của COLOSTRONONI trong mô hình in vitro của biểu mô ruột. Ở cấp độ tế bào, sữa non thể hiện khả năng điều chỉnh sinh lý, các tế bào ruột bắt chước hoạt động tự nhiên của nó trong việc điều hòa và kích thích sự phát triển biểu mô của trẻ ở giai đoạn sơ sinh. Các kết quả được minh họa trong hình 1 cho thấy COLOSTRONONI có thể kích thích sự thay đổi tế bào biểu mô như thế nào trong một mô hình thử nghiệm in vitro. Việc điều chỉnh tăng sinh tế bào là để hỗ trợ việc bảo vệ và tái tạo biểu mô của đường tiêu hóa sau khi biểu mô bị tổn thương và được trung gian bởi lactoferin, một loại protein có trong sữa non, tham gia vào nhiều quá trình tế bào bao gồm phản ứng miễn dịch từ vi khuẩn và nhiễm virus và sự kích thích tăng sinh và biệt hóa tế bào.[30-32] Trong tài liệu, không có tác dụng phụ thứ cấp nào được biết khi sử dụng sữa non bò đông khô và nước ép Morinda citrifolia; thực sự, dữ liệu sơ bộ về việc sử dụng dự phòng sau phẫu thuật của họ ở các tiểu vùng bị ảnh hưởng bởi bệnh Hirschsprung đã xác minh tính an toàn của chúng ngay cả ở những đối tượng đang phát triển như trẻ em.[33] Tác dụng chống oxy hóa và bảo vệ của nước ép Noni trên các tế bào biểu mô là điều cần thiết và hiệp đồng để đạt được kết quả này trong việc tăng cường tác dụng của sữa non.[34-36] Nhiều tài liệu tồn tại về các đặc tính chống oxy hóa, đường huyết và giảm lipid của nước ép Noni. Dùng Noni dẫn đến sự cải thiện nồng độ glucose trong huyết tương điều chỉnh sự biểu hiện của các enzym liên quan đến quá trình tạo gluconeogenolysis và quá trình phân giải đường bằng cách phosphoryl hóa fox01 và cũng ảnh hưởng đến sự hấp thụ lipid trong một chế độ ăn uống đặc biệt giàu chất béo để bảo vệ tim mạch hiệu quả.
COLOSTRONONI đã chứng minh khả năng ảnh hưởng sự biểu hiện của IL-8 cytokine bởi các tế bào ruột (hình 2) với mức độ biểu hiện (+25 lần) thấp hơn nhiều so với mức thường được ghi nhận khi có nhiễm trùng (+300/600 lần). [40] Người ta đã biết rộng rãi rằng nếu một mặt, sự biểu hiện quá mức của IL-8 để phản ứng lại sự xâm nhập của mầm bệnh (vi rút hoặc vi khuẩn) ở cấp độ ruột thì đây là triệu chứng chính của sự gia tăng tính thấm ruột với hậu quả là hiện tượng tiêu chảy, mặt khác, sự biểu hiện sinh lý của IL-8 thực hiện hai chức năng bảo vệ thiết yếu: nó là yếu tố hóa học của bạch cầu trung tính (và đối với các tế bào hạt khác) và chất thúc đẩy quá trình hình thành mạch, cơ chế tái tạo cần thiết để phục hồi các mô bị tổn thương và một phần của các phản ứng sinh lý đối với tổn thương biểu mô. Mặt khác, nếu IL-8 không có ảnh hưởng trực tiếp đến sự tăng sinh của các tế bào biểu mô ruột, thì nó vẫn kích thích đáng kể sự di chuyển của các tế bào biểu mô để thiết lập lại sự luân chuyển bình thường của tế bào.[41] Cả hai quá trình được mô tả đều đóng một vai trò quan trọng trong việc duy trì và tái tạo hàng rào biểu mô ruột trong các điều kiện sinh lý và bệnh lý, đặc biệt liên quan đến các bệnh lý đường tiêu hóa được đặc trưng bởi sự thay đổi của hàng rào biểu mô, chẳng hạn như tất cả các bệnh viêm cấp tính và mãn tính của đường tiêu hóa (IBD và IBS), bệnh celiac và quá nhạy cảm với gluten, hoặc là tổn thương niêm mạc thứ phát do hóa trị và / hoặc xạ trị.
Kết luận
Chế độ ăn uống không đúng cách, lối sống không lành mạnh, stress, tình trạng bệnh lý và dược lý kết nối trong một vòng luẩn quẩn tác động trực tiếp hoặc gián tiếp lên đường tiêu hóa làm thay đổi cân bằng nội môi. Từ dữ liệu được trình bày và từ các tài liệu phong phú hiện có, có thể khẳng định rằng việc sử dụng COLOSTRONONI, trong trường hợp viêm bệnh lý (nguồn gốc độc hại, tự miễn dịch hoặc stress) của đường tiêu hóa, cho phép tái cân bằng và duy trì hệ vi sinh và điều chỉnh tính thấm của ruột, đồng thời thiết lập lại cân bằng nội môi thích hợp của niêm mạc và sự hài hòa sinh lý của trục não-ruột, là những yếu tố quan trọng giúp đường tiêu hóa hoạt động tối ưu.
Dữ liệu thu được từ nghiên cứu cho thấy việc sử dụng COLOSTRO NONI trên lâm sàng trong các bệnh lý đường tiêu hóa được đặc trưng bởi sự gia tăng tính thấm của niêm mạc do chức năng thay đổi của hệ thống đường nối (Tight Junctions), trong IBD, ở các dạng rối loạn tiêu hóa, viêm dạ dày do xói mòn niêm mạc dạ dày và trên lý thuyết cũng có thể sử dụng nó trong các dạng thay đổi bệnh lý của lớp chất nhầy, niêm mạc như bệnh celiac và nhạy cảm với gluten.
Tài liệu tham khảo.
- Pastorelli L, De Salvo C, Mercado JR, Vecchi M, Piz- arro TT. Central role of the gut epithelial barrier in the pathogenesis of chronic intestinal inflammation: lessons learned from animal models and human ge- netics. front Immunol 2013;17:280.
- McGuckin MA, Eri R, Simms LA, florin TH, Radford- Smith G. Intestinal barrier dysfunction in inflamma- tory bowel diseases. Inflamm Bowel Dis 2009;15:100- 13.
- Randall-Demllo S, Chieppa M, Eri R. Intestinal epi- thelium and autophagy: partners in gut homeostasis. front Immunol 2013;30:301.
- Tsuji M, Suzuki K, Kinoshita K, fagarasan S. Dynam- ic interactions between bacteria and immune cells leading to intestinal IgA synthesis. Semin Immunol 2008;20:59-66.
- Cunningham-Rundles S, Ahrné S, Johann-Liang R, Abuav R, Dunn-Navarra AM, Grassey C et al. Effect of probiotic bacteria on microbial host defense, growth, and immune function in human immunodeficiency virus type-1 infection. Nutrients 2011;3:1042-70.
- Ader R. Psychoneuroimmunology. IV ed. Vol. 1 e 2. Amsterdam: Academic Press; 2007.
- Hart A, Kamm MA. Review article: mechanisms of initiation and perpetuation of gut inflammation by stress. Aliment Pharmacol Ther 2002;16:2017-28.
- Uribe A, Alam M, Johansson O, Midtvedt T, Theodor- sson E. Microflora modulates endocrine cells in the gastrointestinal mucosa of the rat Gastroenterology 1994;107:1259-69.
- Collins SM, Bercik P. The relationship between intes- tinal microbiota and the central nervous system in normal gastrointestinal function and disease. Gastro- enterology 2009;136:2003-14
- Salonen A, de Vos WM, Palva A. Gastrointestinal micro- biota in irritable bowel syndrome: present state and perspectives. Microbiology 2010;156(Pt 11):3205-15.
- Longstreth Gf, Thompson WG, Chey WD, Houghton LA, Mearin f, Spiller RC. functional bowel disorders. Gastroenterology 2006;130:1480-91.
- Suzuki T. Regulation of intestinal epithelial permeabil- ity by tight junctions. Cell Mol Life Sci 2013;70:631-59.
- Assimakopoulos Sf, Papageorgiou I, Charonis A. En- terocytes’ tight junctions: from molecules to diseases. World J Gastrointest Pathophysiol 2011;2:123-37.
- Schneeberger EE, Lynch RD. The tight junction: a multifunctional complex. Am J Physiol Cell Physiol 2004;286:C1213-28.
- Shin K, fogg VC, Margolis B. Tight junctions and cell polarity. Annu Rev Cell Dev Biol 2006;22:207-35.
- Keiper T, Santoso S, Nawroth PP, Orlova V, Chavakis T. The role of junctional adhesion molecules in cell- cell interactions. Histol Histopathol 2005;20:197-203.
- Juric M, Xiao f, Amasheh S, May O, Wahl K, Bantel H et al. Increased epithelial permeability is the primary cause for bicarbonate loss in inflamed murine colon. Inflamm Bowel Dis 2013;19:904-11.
- Ivanov AI. Structure and regulation of intestinal epi- thelial tight junctions: current concepts and unan- swered questions. Adv Exp Med Biol 2012;763:132-48.
- Martínez C, Lobo B, Pigrau M, Ramos L, González- Castro AM, Alonso C et al. Diarrhoea-predominant irritable bowel syndrome: an organic disorder with structural abnormalities in the jejunal epithelial bar- rier. Gut 2013;62:1160-8.
- Koch S, Nusrat A. The life and death of epithelia dur- ing inflammation: lessons learned from the gut. Annu Rev Pathol 2012;7:35-60.
- Al-Shmgani HS, Moate RM, Macnaughton PD, Sneyd JR, Moody AJ. Effects of hyperoxia on the perme- ability of 16HBE14o- cell monolayers-the protec- tive role of antioxidant vitamins E and C. fEBS J 2013;280:4512-21.
- Kundumani-Sridharan V, Dyukova E, Hansen DE 3rd, Rao GN. 12/15-Lipoxygenase mediates high-fat diet-induced endothelial tight junction disruption and monocyte transmigration: a new role for 15(S)- hydroxyeicosatetraenoic acid in endothelial cell dys- function. J Biol Chem 2013;288:15830-42.
- Martinez-Medina M, Denizot J, Dreux N, Robin f, Bil- lard E, Bonnet R et al. Western diet induces dysbiosis with increased E coli in CEABAC10 mice, alters host barrier function favouring AIEC colonisation. Gut 2013 [Epub ahead of print].
- Conlon MA, Kerr CA, McSweeney CS, Dunne RA, Shaw JM, Kang S et al. Resistant starches protect against colonic DNA damage and alter microbiota and gene expression in rats fed a Western diet. J Nutr 2012;142:832-40.
- Khan Z, Macdonald C, Wicks AC, Holt MP, floyd D, Ghosh S et al. Use of the ‘nutriceutical’, bovine colos- trum, for the treatment of distal colitis: results from an initial study. Aliment Pharmacol Ther 2002;16:1917- 22.
- Sacerdote P, Mussano f, franchi S, Panerai AE, Bus- solati G, Carossa S et al. Biological components in a standardized derivative of bovine colostrum. J Dairy Sci 2013;96:1745-54.
- Hagiwara K, Kataoka S, Yamanaka H, Kirisawa R, Iwai H. Detection of cytokines in bovine colostrum. Vet Immunol Immunopathol 2000;76:183-90.
- Wang MY, West BJ, Jensen CJ, Nowicki D, Su C, Palu AK et al. Morinda citrifolia (Noni): a literature review and recent advances in Noni research. Acta Pharma- col Sin 2002;23:1127-41.
- Chan-Blanco Y, Vaillant f, Perez AM, Reynes M, Brillouet JM, Brat P. The Noni fruit (Morinda citrifolia L.): A review of agricultural research, nutritional and therapeutic properties. Journal of food Composition and Analysis 2006;19:645-54.
- Buccigrossi V, de Marco G, Bruzzese E, Ombrato L, Bracale I, Polito G et al. Lactoferrin induces con- centration-dependent functional modulation of in- testinal proliferation and differentiation. Pediatr Res 2007;61:410-4.
- Liao Y, Jiang R, Lönnerdal B. Biochemical and molec- ular impacts of lactoferrin on small intestinal growth and development during early life. Biochem Cell Biol 2012;90:476-84.
- Lönnerdal B, Jiang R, Du X. Bovine lactoferrin can be taken up by the human intestinal lactoferrin receptor and exert bioactivities. J Pediatr Gastroenterol Nutr 2011;53:606-14.
- Grandi f, Betalli P, Midrio P, fascetti-Leon f, Gamba PG. Enterocolitis complicating Hirschsprung’s dis- ease: preliminary results of post-operative prophy- laxis with Colostrums. Abstract book and scientific programme of the 17th International Paediatric Color- ectal Club Meeting; 2010 July 17-19; Padua, Italy.
- Chang MS, Kim WN, Yang WM, Kim HY, Oh JH, Park SK. Cytoprotective effects of Morinda officinalis against hydrogen peroxide-induced oxidative stress in Leydig TM3 cells. Asian J Androl 2008;10:667-74.
- Palu A, Su C, Zhou BN, West B, Jensen J. Wound healing effects of noni (Morinda citrifolia L.) leaves: a mechanism involving its PDGf/A2A receptor ligand binding and promotion of wound closure. Phytother Res 2010;24:1437-41.
- Lin YL, Chang YY, Yang DJ, Tzang BS, Chen YC. Beneficial effects of noni (Morinda citrifolia L.) juice on livers of high-fat dietary hamsters. food Chem 2013;140:31-8.
- Wang MY, Peng L, Weidenbacher-Hoper V, Deng S, Anderson G, West BJ. Noni juice improves serum li- pid profiles and other risk markers in cigarette smok- ers. ScientificWorldJournal 2012;2012:594657.
- Palu AK, West BJ, Jensen J. Noni-based nutritional supplementation and exercise interventions influ- ence body composition. N Am J Med Sci 2011;3:552- 6.
- Nerurkar PV, Nishioka A, Eck PO, Johns LM, Volper E, Nerurkar VR. Regulation of glucose metabolism via hepatic forkhead transcription factor 1 (foxO1) by Morinda citrifolia (noni) in high-fat diet-induced obese mice. Br J Nutr 2012;108:218-28.
- Wang H, Moon S, Wang Y, Jiang B. Multiple virus infection alters rotavirus replication and expression of cytokines and Toll-like receptors in intestinal epi- thelial cells. Virus Res 2012;167:48-55.
- Sturm A, Baumgart DC, d’Heureuse JH, Hotz A, Wie- denmann B, Dignass AU. CXCL8 modulates human intestinal epithelial cells through a CXCR1 dependent pathway. Cytokine 2005;29:42-8
- ColostroNoni GUNA tăng cường sức đề kháng cho trẻ nhỏ
- Top 6 đồ uống tốt cho hệ tiêu hóa
- Khám phá ảnh hưởng của COLOSTRONONI lên thành phần hệ vi sinh vật đường ruột của động vật có vú
- Nghiên cứu: Sữa non và các yếu tố tăng trưởng peptide có nguồn gốc từ sữa trong điều trị rối loạn tiêu hóa
- Hiệu quả của sữa non bò và can thiệp dựa trên trứng trong bệnh tiêu chảy cấp ở trẻ em ở Guatemala: Một thử nghiệm ngẫu nhiên, mù đôi, có đối chứng với giả dược

